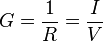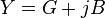Materia es todo aquello que ocupa un lugar en el
espacio. En
física y
filosofía, materia es el término para referirse a los constituyentes de la
realidad material objetiva, entendiendo por objetiva que pueda ser
percibida de la misma forma por diversos sujetos. Se considera que es lo que forma la parte sensible de los objetos perceptibles o detectables por medios físicos. Es decir es todo aquello que ocupa un sitio en el espacio, se puede tocar, se puede sentir, se puede medir, etc.
También se usa el término para designar al tema que compone una obra literaria, científica, política, etc. Esta distinción da lugar a la oposición "materia-forma", considerando que una misma materia, como contenido o tema, puede ser tratado, expuesto, considerado, etc. de diversas
formas: de estilo, de expresión, de enfoque o punto de vista. Se usa también para hablar de una asignatura o
disciplina en la enseñanza.
ATOMO
es la unidad más pequeña de un
elemento químico que mantiene su identidad o sus propiedades, y que no es posible dividir mediante procesos
químicos.
Su denso
núcleo representan el 99.9% de la masa del átomo, y está compuesto de
bariones llamados
protones y
neutrones, rodeados por una nube de
electrones, que -en un átomo neutral- igualan el número de protones. .
El concepto de átomo como bloque básico e indivisible que compone la
materia del
universo fue postulado por la
escuela atomista en la
Antigua Grecia. Sin embargo, su existencia no quedó demostrada hasta el
siglo XIX. Con el desarrollo de la
física nuclear en el
siglo XX se comprobó que el átomo puede subdividirse en
partículas más pequeñas.
[2] [3]
Estructura atómica
La teoría aceptada actualmente: es que el átomo se compone de un núcleo de
carga positiva, donde concentra casi toda la masa del átomo, su tamaño es muy pequeño; está formado por
protones y
neutrones, en conjunto conocidos como
nucleones; alrededor del núcleo se encuentra una
nube de electrones de
carga negativa llamada envoltura, su masa es muy pequeña, su tamaño en general, es muy grande.
[editar] El núcleo atómico
El núcleo del átomo se encuentra formado por nucleones, los cuales pueden ser de dos clases:
- Protones: Partícula de carga eléctrica positiva igual a una carga elemental, y 1,67262 × 10–27 kg y una masa 1837 veces mayor que la del electrón.
- Neutrones: Partículas carentes de carga eléctrica y una masa un poco mayor que la del protón (1,67493 × 10–27 kg).
El núcleo más sencillo es el del
hidrógeno, formado únicamente por un protón. El núcleo del siguiente elemento en la
tabla periódica, el
helio, se encuentra formado por dos protones y dos neutrones. La cantidad de protones contenidas en el núcleo del átomo se conoce como
número atómico, el cual se representa por la letra Z y se escribe en la parte inferior izquierda del
símbolo químico. Es el que distingue a un elemento químico de otro. Según lo descrito anteriormente, el número atómico del hidrógeno es 1 (
1H), y el del helio, 2 (
2He).
La cantidad total de nucleones que contiene un átomo se conoce como
número másico, representado por la letra A y escrito en la parte superior izquierda del símbolo químico. Para los ejemplos dados anteriormente, el número másico del hidrógeno es 1(
1H), y el del helio, 4(
4He).
Existen también átomos que tienen el mismo número atómico, pero diferente número másico, los cuales se conocen como
isótopos. Por ejemplo, existen tres isótopos naturales del hidrógeno, el
protio (
1H), el
deuterio (
2H) y el
tritio (
3H). Todos poseen las mismas propiedades químicas del hidrógeno, y pueden ser diferenciados únicamente por ciertas propiedades físicas.
Otros términos menos utilizados relacionados con la estructura nuclear son los
isótonos, que son átomos con el mismo número de neutrones. Los
isóbaros son átomos que tienen el mismo número másico.
Debido a que los protones tienen cargas positivas se deberían repeler entre sí, sin embargo, el núcleo del átomo mantiene su cohesión debido a la existencia de otra fuerza de mayor magnitud, aunque de menor alcance conocida como la
interacción nuclear fuerte.
[editar] Interacciones eléctricas entre protones y electrones
Antes del
experimento de Rutherford la comunidad científica aceptaba el
modelo atómico de Thomson, situación que varió después de la experiencia de
Rutherford. Los modelos posteriores se basan en una estructura de los átomos con una masa central cargada positívamente rodeada de una nube de carga negativa.
[4]
Este tipo de estructura del átomo llevó a Rutherford a proponer su modelo en que los electrones se moverían alrededor del núcleo en órbitas. Este modelo tiene una dificultad proveniente del hecho de que una partícula cargada acelerada, como sería necesario para mantenerse en órbita, radiaría radiación electromagnética, perdiendo energía. Las
leyes de Newton, junto con la
ecuaciones de Maxwell del electromagnetismo aplicadas al átomo de Rutherford llevan a que en un tiempo del orden de 10
−10 s, toda la energía del átomo se habría radiado, con la consiguiente caída de los electrones sobre el núcleo.
[5]
[editar] Nube de electrones
Alrededor del núcleo se encuentran los electrones que son partículas elementales de carga negativa igual a una
carga elemental y con una masa de 9,10 × 10
–31 kg
La cantidad de electrones de un átomo en su estado
basal es igual a la cantidad de protones que contiene en el núcleo, es decir, al número atómico, por lo que un átomo en estas condiciones tiene una carga eléctrica neta igual a 0.
A diferencia de los nucleones, un átomo puede perder o adquirir algunos de sus electrones sin modificar su identidad química, transformándose en un
ion, una partícula con carga neta diferente de cero.
El concepto de que los electrones se encuentran en órbitas satelitales alrededor del núcleo se ha abandonado en favor de la concepción de una nube de electrones deslocalizados o difusos en el espacio, el cual representa mejor el comportamiento de los electrones descrito por la
mecánica cuántica únicamente como funciones de densidad de probabilidad de encontrar un electrón en una región finita de espacio alrededor del núcleo.
[editar] Dimensiones atómicas
La mayor parte de la masa de un átomo se concentra en el núcleo, formado por los protones y los neutrones, ambos conocidos como
nucleones, los cuales son 1836 y 1838 veces más pesados que el electrón respectivamente.
El tamaño o volumen exacto de un átomo es difícil de calcular, ya que las nubes de electrones no cuentan con bordes definidos, pero su diámetro puede estimarse razonablemente en 1,0586 × 10
–10 m, el doble del
radio de Bohr para el átomo de
hidrógeno. Si esto se compara con el tamaño de un protón, que es la única partícula que compone el núcleo del hidrógeno, que es aproximadamente 1 × 10
–15 se ve que el núcleo de un átomo es cerca de 100.000 veces menor que el átomo mismo, y sin embargo, concentra prácticamente el 100% de su masa.
Para efectos de comparación, si un átomo tuviese el tamaño de un estadio, el núcleo sería del tamaño de una canica colocada en el centro, y los electrones, como partículas de polvo agitadas por el viento alrededor de los asientos.
ELECTRON
comúnmente representado por el símbolo:
e−, es una
partícula subatómica de tipo
fermiónico. En un
átomo los electrones rodean el
núcleo, compuesto únicamente de
protones y
neutrones.
Los electrones tienen una
masa pequeña respecto al
protón, y su movimiento genera
corriente eléctrica, aunque dependiendo del tipo de elemento o compuesto en el que se genere, necesitará más o menos energía para provocar esta corriente eléctrica. Estas partículas desempeñan un papel primordial en la
química ya que definen las atracciones con otros átomos.
Desde el punto de vista físico, el electrón tiene una carga eléctrica contraria a la del protón. Sin embargo, por razones históricas -y ventajas en ecuaciones matemáticas-, se dice que el electrón tiene una
carga eléctrica negativa, en el sentido que es contraria a la carga del protón, que se consideraba
positiva. Sin embargo, esta elección de signo es totalmente arbitraria.
Los electrones son mucho más pequeños que los neutrones y protones. La masa de un simple neutrón o protón es más de 1 800 veces mayor que la masa de un electrón. El tiene una masa de 9,11×10
-28 gramos. Los electrones poseen una carga eléctrica negativa, con una magnitud llamada algunas veces
carga elemental o carga fundamental. Por esto se dice que un electrón tiene una carga de -1. Los protones tienen una carga del mismo valor, pero con polaridad opuesta, es decir +1. La carga fundamental tiene un valor de 1,602×10
-19 coulombios.
PROTON
es una
partícula subatómica con una
carga eléctrica elemental positiva y una masa 1.836 veces superior a la de un
electrón. Experimentalmente, se observa el protón como estable, con un límite inferior en su
vida media de unos 10
35 años, aunque algunas teorías predicen que el protón puede desintegrarse en otras partículas. El protón y el
neutrón, en conjunto, se conocen como
nucleones, ya que conforman el núcleo de los átomos.
En un átomo, el número de protones en el núcleo determina las propiedades químicas del átomo y qué
elemento químico es.
El
núcleo del
isótopo más común del
átomo de
hidrógeno (también el átomo estable más simple posible) es un único protón. Al tener igual carga, los protones se repelen uno del otro,
como dos imanes mirando al mismo polo. Sin embargo, pueden estar agrupados por la acción de la
fuerza nuclear fuerte, que es superior a la
fuerza electromagnética que los repulsa. Por tanto, el núcleo atómico puede existir sin desintegrarse por dicha repulsión. No obstante, cuando el átomo es grande (como los átomos de
Uranio), a veces la repulsión electromagnética puede desintegrar el átomo progresivamente, expulsando partículas alfa, y por tanto, se trata de un átomo radiactivo; es decir, un átomo que progresivamente se convierte en un átomo de otro elemento. Estas desintegraciones pueden durar menos de un segundo, y otras pueden tardar tanto o más que la edad de Universo; por tanto, puede cuantificarse el nivel de desintegración respecto a lo que no se han desintegrado en la misma muestra, y así se puede estimar la edad de una roca (desde su formación) o
planta (desde que se adhirió a la planta).
NEUTRON
El
neutrón es una partícula sin carga neta, presente en el núcleo atómico de prácticamente todos los
átomos, excepto el
protio. Aunque se dice que el neutrón no tiene carga, en realidad está compuesto por tres
partículas fundamentales cargadas llamadas
quarks, cuyas cargas sumadas son cero. Por tanto, el neutrón es un
barión neutro compuesto por dos quarks de tipo
abajo, y un quark de tipo
arriba.
Fuera del núcleo atómico, los neutrones son inestables, teniendo una vida media de 15 minutos (885.7 ± 0.8 s),
[2] ; cada neutrón se descompone en un
electrón, un
antineutrino y un
protón. Su
masa es muy similar a la del protón, aunque ligeramente mayor.
El neutrón es necesario para la estabilidad de casi todos los núcleos atómicos, a excepción del
isótopo hidrógeno-1. La
interacción nuclear fuerte es responsable de mantenerlos estables en los núcleos atómicos.

 , y su unidad es el S/m (
, y su unidad es el S/m ( y la densidad de corriente de conducción
y la densidad de corriente de conducción  :
:
 .
.